
TENKASI® 1200 mg et TENKASI® 400 mg

TENKASI® 1200mg¹

Poudre pour solution à diluer pour perfusion
Pour le traitement d’infections bactériennes aiguës de la peau et des tissus mous (IBAPTM) chez les patients adultes.1
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
1 flacon à 1200 mg1
Chaque flacon contient du diphosphate d’oritavancine équivalant à 1200 mg d’oritavancine.

Posologie / mode d'emploi¹
Adultes seulement
1200 mg en une seule dose de perfusion intraveineuse dans un volume de 250 ml d’une durée de 1 heure.
Pour les instructions de dosage spéciales, voir l’information professionnelle.
Si des réactions liées à la perfusion surviennent, l’arrêt ou le ralentissement de la perfusion peut permettre la disparition de ces symptômes (voir « Effets indésirables »).1

Reconstitution pour les adultes¹
40 ml d’eau stérile pour préparations injectables (EPPI) doivent être ajoutés en utilisant une seringue stérile pour reconstituer le contenu du flacon afin d’obtenir une solution à 30 mg/ml.

Dilution pour les adultes¹
Seules des poches de solution à 5 % de glucose (G5) ou à 0.9 % de chlorure de sodium (NaCl 0.9 %) pour perfusion intraveineuse doivent être utilisées pour la dilution.
Aspirer et jeter 40 ml prélevés dans une poche intraveineuse de G5 ou de NaCl 0.9 % de 250 ml.
Aspirer 40 ml dans le flacon reconstitué et les ajouter dans la poche intraveineuse de G5 ou de NaCl à 0.9 %.
Il en résulte une concentration de 4.8 mg/ml de TENKASI®. Volume final : 250 ml
Stabilité après dilution¹
- La solution diluée doit être utilisée immédiatement.
- Si le médicament n'est pas utilisé immédiatement, la durée et les conditions de conservation avant utilisation relèvent de la responsabilité de l’utilisateur.
- En règle générale, ne pas conserver au-delà de 4 heures à 25 °C ou 12 heures à 2–8 °C après la dilution dans la poche de solution à G5 ou à NaCl 0.9 %.

TENKASI® 400mg²

Poudre pour solution à diluer pour perfusion
Pour le traitement d’IBAPTM chez les patients adultes et pédiatriques à partir de l’âge de 3 mois.2
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
3 flacons de 400 mg2
Chaque flacon contient du diphosphate d’oritavancine équivalant à 400 mg d’oritavancine.
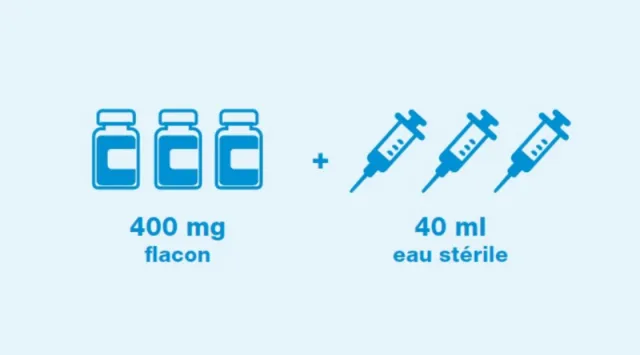
Reconstitution pour les adultes²
40 ml d’eau stérile pour préparations injectables (EPPI) doivent être ajoutés en utilisant une seringue stérile pour reconstituer le contenu de chaque flacon afin d’obtenir une solution à 10 mg/ml par flacon.
3 flacons reconstitués sont nécessaires pour préparer une perfusion de 1200 mg de TENKASI®.
Mode d’emploi chez les enfants et les adolescents (âgés de 3 mois à moins de 18 ans), voir information professionnelle.
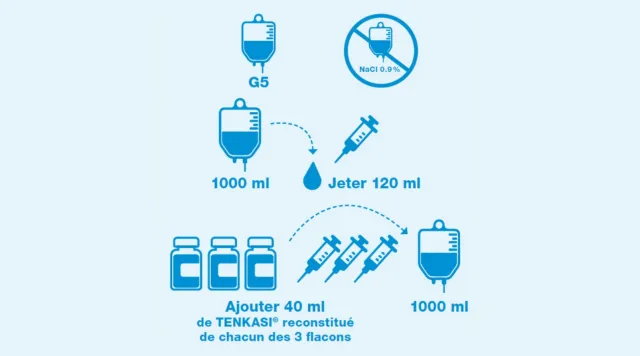
Dilution pour les adultes²
Seule une poche de solution à 5 % de glucose (G5) pour perfusion intraveineuse doit être utilisée pour la dilution. Ne pas utiliser une solution de chlorure de sodium pour la dilution.
Aspirer et jeter 120 ml prélevés dans une poche intraveineuse de G5 de 1000 ml.
Aspirer 3 × 40 ml dans le flacon reconstitué et les ajouter dans la poche intraveineuse de G5. Il en résulte une concentration de 1.2 mg/ml de TENKASI®. Volume final : 1000 ml
1. Information professionnelle TENKASI® 1200 mg poudre pour solution à diluer pour perfusion. www.swissmedicinfo.ch.
2. Information professionnelle TENKASI® 400 mg poudre pour solution à diluer pour perfusion. www.swissmedicinfo.ch.
Veuillez contacter A. Menarini Sàrl pour obtenir les documents et références. A. Menarini Sàrl, Thurgauerstrasse 36/38, 8050 Zurich.
C: Tenkasi 1200 mg poudre pour solution à diluer pour perfusion (i.v.): chaque flacon contient du diphosphate d’oritavancine équivalant à 1200 mg d’oritavancine. Tenkasi 400 mg poudre pour solution à diluer pour perfusion (i.v.): chaque flacon contient du diphosphate d’oritavancine équivalant à 400 mg d’oritavancine. I: Tenkasi 1200 mg: traitement d’infections bactériennes aiguës de la peau et des tissus mous (IBAPTM) chez les adultes. Tenkasi 400 mg: traitement d’infections bactériennes aiguës de la peau et des tissus mous (IBAPTM) chez les adultes et les enfants à partir de l’âge de 3 mois. D: Tenkasi 1200 mg: administrés en une seule dose sous forme de perfusion intraveineuse d’une durée de 1h. Tenkasi 400 mg chez l’adulte: 1200 mg administrés en une seule dose sous forme de perfusion intraveineuse d’une durée de 3 h. Tenkasi 1200 mg et Tenkasi 400 mg: aucun ajustement posologique n’est nécessaire en cas de troubles légers à modérés de la fonction hépatique (Child-Pugh classe B). Aucun ajustement posologique n’est nécessaire en cas de troubles légers à modérés de la fonction rénale, ni chez les patients ≥ 65 ans. Tenkasi 400 mg: Enfants > 3 m à < 18 ans: 15 mg/kg administrés en une seule dose i.v. sur une durée de 3 h (1200 mg au maximum). CI: hypersensibilité au principe actif ou à l’un des excipients. L’utilisation d’héparine sodique non fractionnée i.v. est contre-indiquée pendant 120 h suivant l’administration de l’oritavancine, les résultats des tests évaluant le temps de céphaline activée (TCA) peuvent rester faussement élevés après l’administration de l’oritavancine. PR: des cas de réactions d’hypersensibilité sévères, notamment des réactions anaphylactiques et de choc anaphylactique. En cas de réactions d’hypersensibilité aiguë durant la perfusion d’oritavancine, il faut interrompre immédiatement l’oritavancine et prendre des mesures appropriées. Surveillance étroite des patients ayant des antécédents d’hypersensibilité aux antibiotiques glycopeptides. IA: la prudence est de mise lors de l’administration simultanée de substrats transporteurs à fenêtre thérapeutique étroite (ex. warfarine). Interactions avec les tests de laboratoire: l’oritavancine se lie aux réactifs à base de phospholipides qui activent la coagulation dans les tests de laboratoire de la coagulation couramment utilisés et inhibe ainsi leur action. EI: cellulite, abcès, anémie, céphalées, vertiges, tachycardie, nausées, vomissements, diarrhée, constipation, test anormal de la fonction hépatique, urticaire, rash, prurit, myalgie et réactions au site de perfusion sont des EI fréquents. P: Tenkasi 1200 mg: poudre pour solution à diluer pour perfusion: 1 flacon (A). Tenkasi 400 mg: poudre pour solution à diluer pour perfusion: 3 flacons (A). www.swissmedicinfo.ch. A. Menarini GmbH, 8050 Zurich. V.04.
▼Ce médicament fait l’objet d’une surveillance supplémentaire. Pour de plus amples informations voir l’information professionnelle Tenkasi® sur www.swissmedicinfo.ch.