
TENKASI® 1200 mg und TENKASI® 400 mg

TENKASI® 1200mg¹

Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Zur Behandlung von erwachsenen Patienten mit akuter bakterieller Haut- und Weichgewebeinfektion (ABSSSI).1
Die allgemein anerkannten Richtlinien für den angemessenen Gebrauch von antibakteriellen Wirkstoffen sind zu berücksichtigen.
1 Durchstechflasche zu 1200 mg1
Jede Durchstechflasche enthält Oritavancindiphosphat entsprechend 1200 mg Oritavancin.

Dosierung und Anwendung¹
Nur Erwachsene
1200 mg als intravenöse Infusion als einzelne Dosis in einem Volumen von 250 ml über einen Zeitraum von 1 Stunde.
Spezielle Dosierungsanweisungen siehe Fachinformation.
Falls Infusionsreaktionen auftreten, kann das Stoppen oder Verlangsamen der Infusion zum Abklingen führen (siehe auch Fachinformation «Unerwünschte Wirkungen»).1

Rekonstitution für Erwachsene¹
40 ml steriles Wasser für Injektionszwecke (WFI) sind mit einer sterilen Spritze zwecks Rekonstitution der Durchstechflasche hinzuzufügen, so dass die Durchstechflasche eine Lösung von 30 mg/ml enthält.

Verdünnung für Erwachsene¹
Intravenöse Infusionsbeutel mit Glucose 5% (D5W) oder Natriumchlorid 0.9% (NaCl 0.9%) sind zur Verdünnung zu verwenden.
40 ml der 250 ml eines intravenösen Beutels D5W oder NaCl 0.9% aufziehen und verwerfen.
40 ml aus der rekonstituierten Durchstechflasche aufziehen und in den intravenösen Beutel mit D5W oder NaCl 0.9% spritzen.
Dies ergibt eine Konzentration von 4.8 mg/ml TENKASI®. Finales Volumen: 250 ml
Haltbarkeit nach Verdünnung¹
- Die verdünnte Lösung ist unverzüglich zu verwenden.
- Wenn das Arzneimittel nicht unverzüglich angewendet wird, liegen die Lagerungszeiten und -bedingungen vor der Anwendung in der Verantwortung des Anwenders.
- Normalerweise nicht länger als 4 Stunden bei 25 °C bzw. 12 Stunden bei 2 – 8 °C nach Verdünnung in einem Beutel mit D5W oder NaCl 0.9% lagern.

TENKASI® 400mg²

Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Zur Behandlung von erwachsenen Patienten und pädiatrischen Patienten ab einem Alter von 3 Monaten mit ABSSSI.²
Die allgemeinanerkannten Richtlinien für den angemessenen Gebrauch von antibakteriellen Wirkstoffen sind zu berücksichtigen.
3 Durchstechflaschen zu 400 mg3 Durchstechflaschen zu 400 mg2 Jede Durchstechflasche enthält Oritavancindiphosphat entsprechend 400 mg Oritavancin2.
Jede Durchstechflasche enthält Oritavancindiphosphat entsprechend 400 mg Oritavancin.
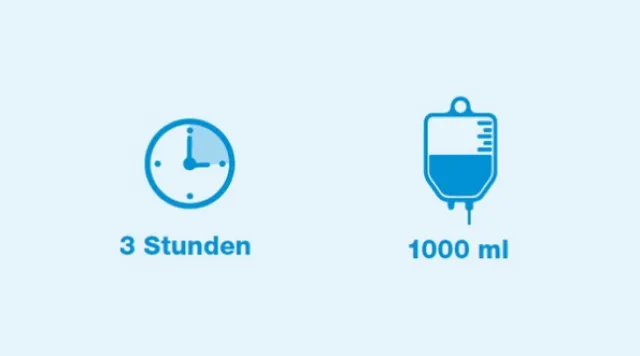
Dosierung und Anwendung²
Erwachsene
1200 mg als intravenöse Infusion als einzelne Dosis in einem Volumen von 1000 ml über einen Zeitraum von 3 Stunden.
Kinder und Jugendliche im Alter von 3 Monaten bis <18 Jahren
15 mg/kg als intravenöse Infusion als einzelne Dosis über einen Zeitraum von 3 Stunden (höchstens 1200 mg).
Spezielle Dosierungsanweisungen und Dosiertabelle für pädiatrische Patienten siehe Fachinformation. Falls Infusionsreaktionen auftreten, kann das Stoppen oder Verlangsamen der Infusion zum Abklingen führen (siehe auch Fachinformation «Unerwünschte Wirkungen»).²
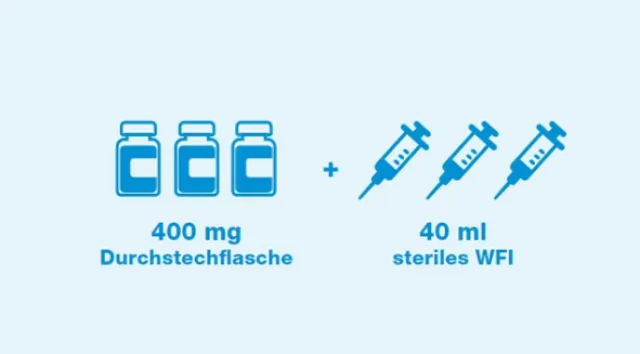
Rekonstitution für Erwachsene²
40 ml steriles Wasser für Injektionszwecke (WFI) sind mit einer sterilen Spritze zwecks Rekonstitution jeder Durchstechflasche hinzuzufügen, bis jede Durchstechflasche eine Lösung von 10 mg/ml enthält. 3 rekonstituierte Vials werden für die Herstellung einer Infusion mit 1200 mg TENKASI® benötigt.
Anwendung bei Kindern und Jugendlichen (im Alter von 3 Monaten bis unter 18 Jahren) siehe Fachinformation.
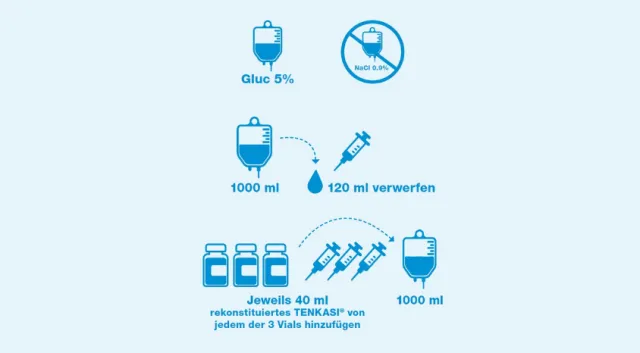
Verdünnung für Erwachsene²
Zur Verdünnung sollten nur Infusionsbeutel mit 5%iger Glukose (D5W) verwendet werden. Natriumchloridlösung darf nicht zur Verdünnung verwendet werden.
120 ml der 1000 ml eines intravenösen Beutels D5W aufziehen und verwerfen.
3 × 40 ml aus den rekonstituierten Durchstechflaschen aufziehen und in den intravenösen Beutel mit D5W spritzen. Dies ergibt eine Konzentration von 1.2 mg/ml TENKASI®. Finales Volumen: 1000 ml
Haltbarkeit nach Verdünnung²
- Die verdünnte Lösung ist unverzüglich zu verwenden.
- Wenn das Arzneimittel nicht unverzüglich angewendet wird, liegen die Lagerungszeiten und -bedingungen vor der Anwendung in der Verantwortung des Anwenders.
- Normalerweise nicht länger als 4 Stunden bei 25 °C bzw. 12 Stunden bei 2 – 8 °C nach Verdünnung in einem Beutel mit D5W oder NaCl 0.9% lagern.
1. Fachinformation TENKASI® 1200 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. www.swissmedicinfo.ch.
2. Fachinformation TENKASI® 400 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. www.swissmedicinfo.ch.
Unterlagen und Referenzen können bei A. Menarini GmbH angefordert werden. A. Menarini GmbH, Thurgauerstrasse 36/38, 8050 Zürich.
Z: Tenkasi 1200 mg Pulver für Konzentrat zur Herstellung einer Infusionslösung (i.v.): Jede Durchstechflasche enthält Oritavancindiphosphat entsprechend 1200 mg Oritavancin. Tenkasi 400 mg Pulver für Konzentrat zur Herstellung einer Infusionslösung (i.v.): Jede Durchstechflasche enthält Oritavancindiphosphat entsprechend 400 mg Oritavancin. I:Tenkasi 1200 mg: Behandlung akuter bakterieller Haut- und Weichgewebeinfektion (ABSSSI) bei Erwachsenen. Tenkasi 400 mg: Behandlung akuter bakterieller Haut- und Weichgewebeinfektion (ABSSSI) bei Erwachsenen und pädiatrischen Patienten ab einem Alter von 3 Monaten. D: Tenkasi 1200 mg: 1200 mg als einzelne Dosis i.v. über 1h verabreicht. Tenkasi 400 mg bei Erwachsenen: 1200 mg als intravenöse Infusion als einzelne Dosis über 3 h. Tenkasi 1200 mg und Tenkasi 400 mg: Bei leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse B) keine Dosisanpassung erforderlich. Bei leichter oder mittelschwerer Nierenfunktionsstörung keine Dosisanpassung erforderlich. Bei Patienten von ≥ 65 J keine Dosisanpassung erforderlich. Tenkasi 400 mg: Pädiatrische Patienten >3 m bis <18 Jahre: 15 mg/kg als einzelne i.v. Dosis über einen Zeitraum von 3 h (höchstens 1200 mg) KI: Überempfindlichkeit gegen den Wirkstoff oder einen sonstigen Bestandteil. Anwendung von i.v. unfraktioniertem Heparin-Natrium ist für einen Zeitraum von 120 h nach Oritavancin kontraindiziert: für die aktivierte partielle Thromboplastinzeit (aPTT) können nach Anwendung von Oritavancin fälschlicherweise erhöhte Werte gemessen werden. VM: Schwerwiegende Überempfindlichkeitsreaktionen, inkl. anaphylaktischer Reaktionen und anaphylaktischer Schock. Bei Auftreten einer akuten Überempfindlichkeitsreaktion während der Infusion, Oritavancin sofort absetzen und unterstützende Massnahmen ergreifen. Sorgfältige Überwachung von Patienten mit einer Vorgeschichte von Glykopeptid-Antibiotika Überempfindlichkeit. IA: Vorsicht bei gleichzeitiger Verabreichung von Transportersubstraten mit engem therapeutischem Fenster (z.B. Warfarin). Wechselwirkungen mit Labortests: Oritavancin bindet an Phospholipid-Reagenzien, die in gängigen Koagulationstests im Labor die Koagulation aktivieren, und hemmt dadurch deren Wirkung. UAW: Cellulitis, Abszess, Anämie, Kopfschmerzen, Schwindel, Tachykardie, Übelkeit, Brechreiz, Diarrhö, Obstipation, anormaler Leberfunktionstest, Urtikaria, Ausschlag, Pruritus, Myalgie und Reaktionen an der Einstichstelle sind häufig. P: Tenkasi 1200 mg: Pulver für ein Konzentrat zur Herstellung einer Infusionslösung: 1 Durchstechflasche (A). Tenkasi 400 mg: Pulver für ein Konzentrat zur Herstellung einer Infusionslösung: 3 Durchstechflaschen (A). www.swissmedicinfo.ch. A. Menarini GmbH, 8050 Zürich. V.04.
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Für weitere Informationen, siehe Fachinformation Tenkasi® auf www.swissmedicinfo.ch.
METEN5559_25.06D